Atom
Dät Atom is ne submikroskopiske Struktur, ju der in aal gewöönelke Materie foarkumt. Atome bestounde uut subatomiske Deele: Elektrone, Protone un Neutrone. Atome hääbe ju Drift, sik tou kombinierjen uum Moleküle tou bildjen. N Woatermolekül toun Biespil bestoant uut two Woaterstofatome un een Suurstofatom. Atome sunt do fundamentelle Bausteene fon ju Chemie un do wäide in chemiske Reaktione sieläärge nit fernichted. Dät rakt bloot 91 Typen fon chemiske Bausteene of chemiske Elemente, do in ju Natuur ap de Äide fuunen wäide. Jo wäide klassifizierd in ju periodiske Tabelle. Ju Klassifikation is gruunded ap ju Antaal Protone in dät Atom. Uur Typen Atome konnen kunstelk moaked wäide, man do sunt nit stabil un breeke bie litjen oawe ätter natüürelke chemiske Elemente truch Käädenkleeuwenge.
Atome fon dätsälge Element konnen ferscheedene radioaktive Oainskuppe hääbe, gruunded ap ju Antaal Neutrone in dän Kääden. Atome mäd jusälge Taal Protone, man ferscheedene Taale Neutrone, wäide Isotope fon dätsälge chemiske Element naamd. Deeruum dät Atome alleweegense foarkuumen dwo, sunt do al jierhunnerteloang Fäild fon Studium. Apstuuns gjuchte do Unnersäikengen sik foarallen ap Kwantum-Effekte, as in Bose-Einstein-Kondensaat.
Atomtheorie
[Beoarbaidje | beoarbaidje Wältext]Ju Atomtheorie is ne Theorie uur dät Weesen fon ju Materie. Ju Theorie kwäd, dät aal Materie uut Atome bestoant.
Do griechiske Philosophe, as Leucippus un Democritus, hääbe uur dät Weesen fon ju Materie ättertoacht. Hiere Toanken häd, eenfach gekweeden, dissen Wai foulged: Wan n Materioal as t.B. Gould ap breeken wäd, annert dät Weesen fon do litje Stukke sik nit - dät is noch altied Gould. Do Griechen hääbe spikkelierd dät, wan do Stukke in noch litjere Stukke apbreeken wäide, der woarschienelk n Stoadium kuumen däd, wier do litje Deele nit fääre apbreeken wäide konnen. In dät Griechiske betjut dät Woud “atomos” ‘nit scheedboar’. Dät is wierhäär dät Woud ‘Atom’ oulat is.
Struktuur
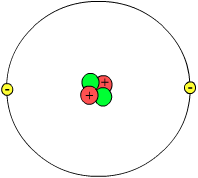
[Beoarbaidje | beoarbaidje Wältext]Sub-atomiske Partikele
[Beoarbaidje | beoarbaidje Wältext]Atome bestounde haudseekelk uut loose Ruumte, man uk uut litje subatomiske Deele. Midde in dät Atom is n litje positive leedenen Kääden, die der bestoant uut Nukleone, as me do Protone u n Neutrone touhoope naamt. Die Räst fon dät Atom bestoant uut do smiedige Elektroneschille. Deerbie häd n Proton ne positive elektriske Leedenge un n Elektron ne ieuwen groote negative Leedenge. In n neutroal Atom is deeruum ju Antaal Protone un Elektrone gliek un sunt do Leedengen juununner uutwain.
Leedene Atome wäide Ione naamd. Atome mäd minner Elektrone as Protone hääbe ne positive Leedenge un sunt bekoad as Katione. Deer juunuur hääbe Atome mäd moor Elektrone as Protone ne negative Leedenge un do wäide as Anione beteekend.
Elektrone traale uum dän Kääden tou mäd groote Gauegaid. Jo traale uk in ferscheeden Oustande fon dän Kääden. Me kwäd, dät do Naiste an dän Kääden kuume in een Schil foar un do der fääre wäch sunt in wier n uur Schil. Älk Schil kricht n Nummer: dät Naiste an dän Kääden is Schil 1, dät foulgjende fon dän Kääden ou reekend wäd Schil 2 naamd, usw. Die Kääden is moor as 100.000 Moal litjer as dät Atom; ju Grööte fon dät Atom wäd also bestimd truch ju Grööte fon dät buuterste Elektronschil. Wan wie n Atom fergratterjen dieden tou ju Grööte fon gans Seelterlound, dan waas die Kääden deer midde oane noch litjer as sun litjen Golfbaal!
Elemente un Isotope
[Beoarbaidje | beoarbaidje Wältext]Atome wäide gewöönelk klassifizierd ätter hiere Atomtaale, do der stimmen dwo tou ju Taal Protone in dät Atom (in näitroale Atome is dät gliek an ju Taal Elektrone). Ju Atomtaal bestimt ju Familie of dät Element, wier dät Atom tou heert. Koolstof-Atome sunt toun Biespil do eensichste Atome, do der 6 Protone änthoolde. Aal do Atome mäd jusälge Atomtaal deele ne wiede Ferscheedenhaid fon physiske Oainskuppe un ferhoolde sik chemisk gliek. Do ferscheedene Typen Atome wäide in ju periodiske Tabelle beteekend. JuMassentaal of Nukleontaal tält do ganse Protone un Neutrone, do der in dät Atom foarkuume. Ju Antaal Neutrone häd naan Ienfloud ap ju Elementklassifikation fon n fon n Atom. N chemisk Element is also n e ganse ‘Atomfamilie’un deeroun konnen also ferscheedene Atomtypen foarkuume, do der jusälge Atomtaal hääbe, man ferscheedene Massentaale. Do Atomtypen wäaide dan Isotope fonnunner naamd.
Uum n Isotop fon n uur Isotop in sien Elementfamilie tou unnerscheeden, schrift me bääte dän Noome fon n Element sien Massentaal, t.B. Koolstof 14 (wät bestoant uut 6 Protone un 8 Neutrone in älk Atom}.
Dät eenfachste Atom is dät Woaterstof-Atom, mäd Atomtaal fon 1 un wät bestoant uut n Proton un n Elektron. Die Woaterstof-Isotop die der 1 Neutron äkstroa änthaalt, wäd Deuterium naamd, un die Woaterstof-Atom mäd two äkstroa Neutrone hat Tritium. Do Isotope wieren n Themoa, wät gjucht Interesse in ju Wietenskup apruupen häd, foarallen in ju äddere Äntwikkelenge fon ju Quantentheorie.
Buuterste Schille un Ferbiendenge
[Beoarbaidje | beoarbaidje Wältext]Dät chemiske Ferhoolden fon Atome is haudseekelk tou tonkjen an ju Interaktion twiske hiere Elektrone. Foarallen do Elektrone in dät buuterste Schil, do der Valenz-Elektrone naamd wäide, hääbe dän grootsten Ienfloud ap dät chemiske Ferhoolden. Käädenelektrone (do, do der nit in dät buuterste Schil foarkuume) spielje wäil ne sekundäre Rulle, haudseekelk weegen dät Ouschirmengseffekt fon ju positive Leedenge in dän Atomkääden.
Älk Schil uum dän Kääden tou kon man ne bestimde Taal Elektrone bierge:
Schil 1: - 2 Elektrone
Schil 2: - 8 Elektrone
Schil 3: - 8 of 18 Elektrone (ouhongich fon dät Element wier sik dät uum honnelt)
Älk Atom, wät n ful (of loos) buuterst Schil häd, is moor stoabil. Atome beloangje ju Stoabilität truch Elektrone tou deelen mäd Noaber-Elektrone of truch Elektrone fon uur Atome gans un goar wächtouhoaljen. Wan Elektrone deeld wäide, wäd ne kovalente Ferbiendenge bilded.
Kovalente Ferbiendengen sunt do stäärkste atomiske Ferbiendengen. Ap disse Wiese blieuwe Atome touhoope in Gruppen, do der Moleküle naamd wäide. Do Elektrone in dät buuterste Schil traale dan uum aal do Atome tou, wät älk individuel Atom dan lät mäd n ful (also stoabil) buuterst Schil.
Wan een of moorere Elektrone gans fon n Atom wächhoald wäide truch n uur Atom, dan wäd n Ion bilded. Ione sunt Atome, do der ne Netto-Leedenge hääbe, infoulge fon dät Uungliekwicht in ju Taal Protone un Elektrone. Wäkke Atome, as Natrium, hääbe man een Elektron in dät buuterste Schil.
Uur, as Chlor, hougje juust man een Elektron, uum dät buuterste Schil fultoumoakjen. Wan Natrium-Atome Kontakt moakje mäd Chlor-Atome, dan rakt älk Natrium-Atom sien buuterste Elektron ou an n Chlor-Atom. Do Natrium-Atome kriege dan ne positive Leedenge un do Chlor-Atome ne negative Leedenge. Dät Ion dät dät Elektron ‘stuulen’ häd, wäd dät Anion naamd un is negaitiv leeden. Deerjuun wäd dät Atom dät sien Elektron ferlädden häd, n Kation naamd un is positiv leeden. Katione un Anione wäide ätternunner tou leeken infoulge fon do Coulombkrafte twiske do positive un negative Leedengen. Ju Anluukkraft wäd elektrovalente of ioniske Kraft naamd un is swäkker as kovalente Ferbiendengen.
